Perbedaan Antara Molaritas, Molalitas, Dan Normalitas
Perbedaan Antara Molaritas Molalitas Dan Normalitas - Larutan memiliki beberapa sifat fisi seperti warna, bau, rasa, Ph, titik didih, titik beku, dan sebagainya. Sifat fisi larutan yang akan kita bahas kali ini adalah sifat koligatif larutan yaitu sifat larutan yang hanya tergantung pada konsentrasi partikel zat terlarut. Sifat koligatif tersebut terdiri atas penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Apakah anda pernah mencoba mengukur suhu air saat air mendidih? Jika airnya mendidih pada suhu 100ᵒC, apakah air yang telah di tambah bahan lainnya seperti sayuran tetap akan mendidih pada suhu 100ᵒC? bagaimana jika di tambah lagi dengan bahan-bahan seperti garam dan gula? Masihkah sama suhunya? Nah, untuk memahami ini, kita harus mempelajari konsep perhitungan dasar dalam sifat koligatif larutan atau lebih jelasnya mengenai konsentrasi larutan.
Konsentrasi Larutan
Larutan adalah campuran homogen yang terdiri dari zat terlarut dan pelarut. Pada saat membuat suatu larutan, kita akan memiliki zat terlarut yaitu zat yang akan dilarutkan dan zat pelarut. Pelarut yang biasa di gunakan adalah air (akuades). Jumlah zat terlarut yang dilarutkan dalam suatu pelarut dinyatakan sebagai konsentrasi larutan. Ada beberapa cara untuk menyatakan secata kuantitatif perbandingan zat terlarut dalam pelarut yaitu molaritas (kemolaran (M)), molalitas (Kemolalan (m)) dan juga Normalitas (N) satu lagi yang akan kita bahas kali ini.
Konsentrasi larutan akan tinggi (pekat) bila zat terlarutnya banyak dan zat pelarutnya sedikit.
Konsentrasi larutan akan rendah (encer) bila zat terlarutnya sedikit dan zat pelarutnya banyak.
Molaritas (M)
Molaritas menyatakan jumlah mol zat terlarut dalam setiap satu liter larutan. Molaritas dilambangkan dengan notasi M dan satuannya adalah mol/liter. Secara matematis dirumuskan seperti berikut:
 |
| Rumus Molaritas |
Jika volume larutan dinyatakan dalam ml maka rumus molaritas dapat dinyatakan dengan:
 |
| Rumus Molaritas |
Keterangan:
M : molaritas (mol/L)
n : Jumlah mol (mol)
V : Volume larutan (L)
m : massa zat terlarut
Mr : massa molekul relative
Jika dilakukan pengenceran larutan maka berlaku: mol zat terlarut sebelum pengenceran = mol zat terlarut sesudah pengenceran.
| Rumus Molaritas |
Keterangan:
V1 = Volume sebelum pengenceran
M1 = molaritas sebelum pengenceran
V2 = volume sesudah pengenceran
M2 = molaritas sesudah pengenceran
Jika dilakukan pencampuran maka berlaku rumus:
 |
| Rumus Molaritas |
Keterangan :
VA = Volume zat A
VB = Volume zat B
MA = Molaritas zat A
MB = Molaritas zat B
Contoh Soal Molaritas
NaOH sebanyak 10 gr dilarutkan dalam air sehingga diperoleh 500 ml larutan NaOH (Mr = 40). Hitung kemolaran larutan tersebut?
Jawab:
 |
| Penyelesaian soal molaritas |
Jika 20 ml HCL 5 M di encerkan menjadi 0,4 M. berapa jumlah air yang harus ditambahkan pada larutan?
 |
| Penyelesaian soal molaritas |
Jawab:
Jika 7 liter HCL 0,3 M dicampurkan dengan 500 ml HCL 0,2 M. berapa konsentrasi larutan HCL yang diperoleh?
Jawab:
 |
| Penyelesaian soal molaritas |
Molalitas (m)
Kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut. Secara matematis, dapat dirumuskan:
 |
| Molalitas |
Keterangan:
m = molalitas
g = massa zat terlarut
P = massa zat pelarut
Mr = massa molekul relatif
Contoh Soal Molalitas:
Jika ke dalam 250 gr air ditambahkan 17,1 gr larutan gula tebu (Mr = 342). Hitung molalitas larutan?
Jawab:
| Penyelesaian Molalitas |
Jika ke dalam 200 ml air ditambahkan 2 gram NaOH, berapakah molalitas, fraksi mol, dan fraksi berat larutan tersebut?
Jawab:
 | |
|
Terdapat perbedaan antara molaritas dengan molaliltas, agar lebih mudah memahaminya bisa melihat perbedaan keduanya melalui gambar berikut:
Normalitas (N)
Normalitas menyatakan jumlah ekuivalen zat terlarut dalam 1 liter larutan.
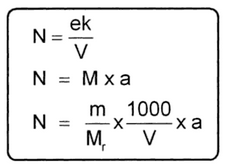 |
| Rumus Normalitas |
Keterangan:
N = Normalitas larutan
ek = ekuivalen zat terlarut
V = volume larutan
M = molaritas
a = valensi (banyaknya ion)
m = massa zat terlarut
Jika dilakukan pengenceran maka akan berlaku rumus sebagai berikut:
 |
| Rumus Normalitas |
Keterangan:
N1V1 = normalitas dan volume sebelum pengenceran
N2V2 = normalitas dan volume sesudah pengenceran
Jika dilakukan penetralan maka akan berlaku rumus:
 |
| Rumus Normalitas |
Sedangkan jika untuk reaksi redoks (reduksi-oksidasi) maka akan berlaku rumus:
 |
| Rumus Normalitas |
Agar lebih mudah memahami mengenai normalitas, mari perhatikan contoh dibawah ini:
Berapa gr larutan 0,25 N asam sulfat (Mr= 98) dalam 500 liter larutan?
Jawab:
Reaksi: H2SO4 è 2H+ + SO4-2
Normalitas = 0,25 N dan a = 2 (terdapat 2 ion H+)
 |
| Contoh Normalitas |
Nah, sahabat setia trendilmu.com, sebenarnya jika kita mau mempelajarinya tidak akan sulit hanya dibutuhkan sedikit waktu dan usaha untuk memahaminya. Silahkan pelajari kembali. Semoga bermanfaat!
baca juga tentang kegunaan unsur-unsur di alam.

0 Response to "Perbedaan Antara Molaritas, Molalitas, Dan Normalitas"
Post a Comment